Ученые Центра исследований молекулярных механизмов старения и возрастных заболеваний МФТИ и Института биоорганической химии РАН исследовали взаимодействие перспективного лекарственного средства и предшественника пептида, вовлеченного в нейродегенерацию. Результаты стали существенным шагом к лечению болезни Альцгеймера.
С момента первого описания болезни Альцгеймера прошло более ста лет, но ее причины и молекулярные механизмы до сих пор до конца не раскрыты. Эффективного лечения заболевания также не существует.
Клинические проявления болезни Альцгеймера объясняются избирательной дегенерацией нейронов в участках коры головного мозга, ответственных за когнитивное восприятие и память.
Известно, что в развитии заболевания задействованы различные пептиды и белки, в том числе амилоидогенные: прежде всего, бета-амилоидный пептид (Aβ), а также взаимодействующие с ним Тау-белок и прионный белок PrP. Вне нервных клеток, в местах контакта нейронов, накапливается пептид Aβ, который собирается в протяженные упорядоченные структуры — фибриллы, формирующие так называемые амилоидные бляшки.
Существующие методы лечения основаны на разрушении внеклеточных отложений Aβ, что может привести к возникновению гораздо более опасных малых олигомеров Aß, способных воздействовать на функцию амилоидогенных белков, мембранных рецепторов и каналов, а также на работу внутриклеточных органелл, приводя к угнетению функции нейронов и клеточной смерти.
Нормальная биологическая функция пептида β-амилоида (Aβ) пока непонятна. Тем не менее, изоформы Aβ встречаются у людей независимо от возраста и наличия проявлений болезни; в мономерной форме они могут играть роль в сигнальных путях в головном мозге и иметь нейропротекторные свойства при низких концентрациях.
Все изоформы пептидов Aβ склонны к объединению. Олигомеры, то есть несколько сгруппированных вместе в пространстве молекул, играют решающую роль в патогенезе болезни Альцгеймера, оказывая токсическое действие на нейроны и их органеллы. Поэтому профессор Дитер Вильбольд разработал так называемый D-энантиомерный пептид D3 и его производные для разборки и разрушения цитотоксических малых олигомеров Aβ2. Сейчас одно из D3-подобных соединений находится в фазе II клинических испытаний.
Российские ученые опубликовали результаты исследований, где продемонстрировали, что пептид D3, стабилизирующий мономер Aβ, динамически взаимодействует с прилегающей к мембране областью мембранного белка предшественника Aβ — CTFβ, содержащего последовательность Aβ1-42. Молекулярное моделирование дает возможность утверждать, что D3 нацелен на амилоидогенную область Aβ. Тем самым он подавляет ранние стадии приобретения пептидом Aβ β-конформаций характерных для малых токсичных олигомеров.
Также авторы исследования показали, что что D3, как и Aβ1-42, является неупорядоченным белком (IDP). А при взаимодействии D3 и Aβ1-55 образуется подвижный, но устойчивый комплекс, в котором конформации обоих полипептидов постоянно изменяются с изменением паттерна межмолекулярных контактов. Такие динамические межмолекулярные взаимодействия D3 пептидов лежат в основе их молекулярного механизма разрушения цитотоксических β-амилоидных олигомеров, а именно подавления контактов между Aβ пептидами и сохранения их в α-спиральной конформации, что предотвращает их переход в β-тяжи.
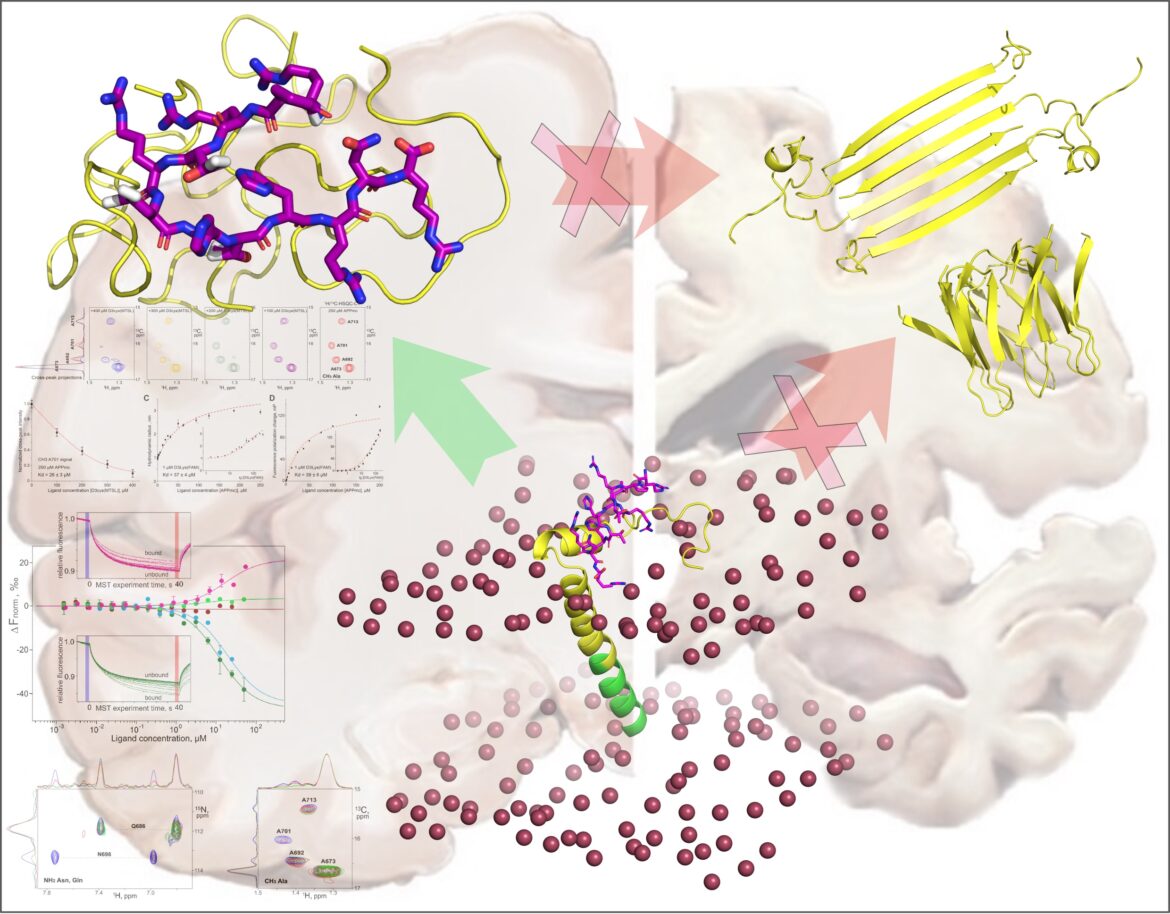
Детальное понимание структурной динамики IDP белков, в частности, молекулярного механизма действия ингибиторов олигомеризации Aβ способствует определению молекулярных мишеней и разработке перспективных лекарственных средств для лечения и профилактики болезни Альцгеймера.
Исследования были выполнены в рамках проекта поддержанного РНФ (20-64-46027), они являются результатом эффективного многолетнего научно-технического сотрудничества России и Германии.






